Principais diferenças entre compostos orgânicos (CO) e compostos inorgânicos (CI)
Sabemos que atualmente o composto orgânico é aquele que apresenta átomos de carbono em sua estrutura e composto inorgânico é aquele que não apresenta em sua composição o átomo de carbono, exceto alguns compostos que mesmo tendo carbono apresenta propriedades dos compostos inorgânicos.
As principais diferenças entre os compostos orgânicos e inorgânicos residem quanto ao número de compostos e elementos químicos constituintes, natureza dos compostos, estabilidade térmica, ponto de fusão e ponto de ebulição e combustão.
- Número de Compostos e Elementos Químicos Constituintes
Apesar do elevado número de Compostos Orgânicos (elevado número devido à propriedade de os átomos de carbono poderem ligar-se entre si, formando cadeias), o número de elementos químicos constituintes é muito pequeno, ou seja, os compostos orgânicos, em sua maioria, são formados pelos mesmos elementos, os chamados organógenos: Carbono (C), Hidrogênio (H), Oxigênio (O) e Nitrogênio (N). Na constituição de Compostos Inorgânicos há grande variedade de elementos químicos.
- Quanto à Natureza dos Compostos
Os compostos orgânicos são, em sua maioria, COVALENTES OU MOLECULARES, enquanto que os compostos inorgânicos são IÔNICOS. Isso devido ao fato de os compostos orgânicos, em sua maioria, serem formados pelos elementos organógenos, os quais permitem ligação covalente ou molecular entre si. Já os compostos inorgânicos, em sua maior parte, apresentam metais combinados com não-metais e, consequentemente, são compostos iônicos.
- Estabilidade Térmica
A maior parte dos compostos orgânicos se DECOMPÕE quando são aquecidos a 500ºC. Já os compostos inorgânicos - raros os que se decompõem nessa temperatura - são tão numerosos que não se decompõem acima de 1.000ºC e a até mesmo 2.000ºC. Um exemplo simples é a comparação da estabilidade térmica entre o açúcar (composto orgânico) e o sal comum (composto inorgânico).
Perceba a diferença da estabilidade térmica entre a Sacarose (composto orgânico) e o Cloreto de Sódio (composto inorgânico). É possível concluir que os compostos inorgânicos são mais estáveis (resistem mais à temperatura).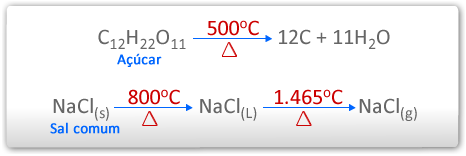
- Ponto de Fusão e Ponto de Ebulição
Os compostos orgânicos sólidos geralmente apresentam ponto de fusão em temperaturas compreendidas entre 30ºC e 400ºC. Os compostos orgânicos líquidos também variam entre limites bastante amplos de temperatura de ebulição. Os compostos inorgânicos geralmente apresentam pontos de fusão e ebulição mais elevados.
- Combustão
A maioria dos compostos orgânicos são combustíveis, ou seja, combinam com o gás oxigênio formando gás carbônico e água. Exemplo:

- Solubilidade e estado físico
Substâncias polares tendem a dissolver substâncias polares, enquanto substâncias apolares dissolvem substâncias apolares, é a regra “semelhante dissolve semelhante”. Por esse motivo, substâncias inorgânicas (iônicas) são solúveis em água (polar) enquanto que as substâncias orgânicas (covalentes) são solúveis em solventes orgânicos ( benzeno, éter , gasolina, etc.) chamados de apolares.
Quanto ao estado físico, os orgânicos são geralmente líquidos e os inorgânicos são geralmente sólidos.
- Densidade
As substâncias orgânicas são, em geral, pouco densas (tem densidade menor que da água) por este motivo, quando insolúveis em água essas substâncias formam uma camada que “flutua” sobre a água, como acontece com a gasolina, o éter comum , o benzeno, etc. Substâncias orgânicas contendo um ou mais átomos de massas atômicas elevadas podem ser mais densas que a água , exemplo CHBr3 é três vezes mais denso que a água.
- Velocidade das reações
Existem dois tipos fundamentais de reações: iônicas e moleculares. As reações iônicas são dotadas de grande velocidade, enquanto que as reações moleculares são relativamente lentas.
Conclusão:
Compostos Inorgânicos - Reações Iônicas - Rápidas
Compostos Orgânicos - Reações Moleculares - Lentas
Observação: As reações são lentas, necessitando frequentemente de ativadores, tais como: luz, calor, catalisador, pressão, etc.
Exemplos:
INORGÂNICA: NaCl + AgNO3 frio NaNO3 + AgCl (preciptado branco)
ORGÂNICA : CH3Cl + AgNO3 quente CH3NO3 + AgCl (preciptado branco)