Características gerais do Átomo de Carbono
O átomo de carbono apresenta certas peculiaridades que o tornam bem diferentes de todos os demais elementos químicos; esse fato foi percebido por Kekulé na metade do século XIX. Dentre as principais características do átomo de carbono, podemos destacar os três postulados de Kekulé:
- O carbono é tetravalente (Primeiro postulado de Kekulé)
O carbono está situado no grupo 14 ou família 4 A, apresentando número atômico igual a 6. Através do diagrama de Pauling e a Regra de Aufbau, podemos detectar que a primeira camada apresenta 2 elétrons e a última camada 4 elétrons. O fator de apresentar 4 elétrons na última camada possibilita ao carbono procurar a estabilidade por mais 4 elétrons, obedecendo a regras do octeto. Isso demonstra, então, que ele é tetravalente e realiza essas ligações por covalência.
Distribuição em subníveis : 1s2 2s2 2p2
Distribuição em níveis ou camadas: K2 L4
Distribuição em orbitais
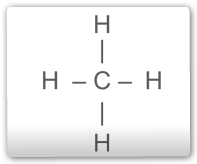
Fórmula estrutural plana para o metano:
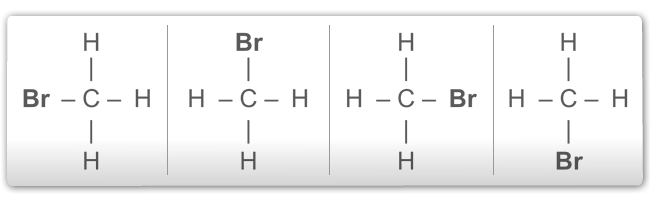
Além disso, as 4 valências do carbono são iguais entre si. Assim sendo, por exemplo, as 4 fórmulas exemplificadas a seguir representam, na realidade, um único composto, de fórmula molecular CH3Br:
Fórmulas estruturais planas
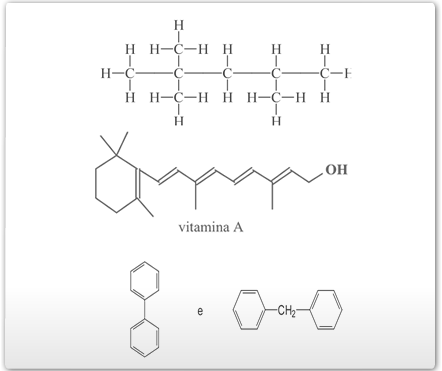
- O carbono forma ligações múltiplas (Segundo postulado de Kekulé)
O carbono pode fazer ligações simples, duplas e triplas, com vários átomos, principalmente com o próprio carbono (C) e outros átomos.
Veja os exemplos abaixo:
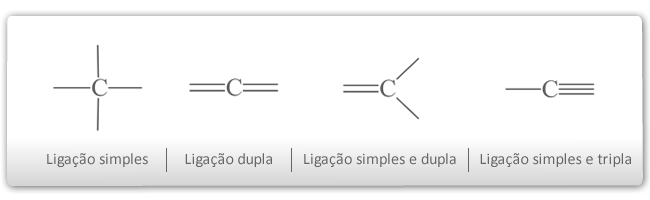
Sendo assim, o carbono pode ligar-se a vários tipos de elementos químicos. O carbono que apresenta 4 elétrons na última camada, raio pequeno tem a propriedade de estabelecer ligações entre os metais e os não–metais. O hidrogênio (H) sempre aparece nos compostos orgânicos típicos. Exceções: CCl4, C2Cl6, CCl2F2, etc.
Em menor proporção também faz ligação o enxofre (S), o fósforo (P) e certos metais como ferro (Fe), magnésio (Mg), zinco (Zn), chumbo (Pb), etc..
Depois do hidrogênio os elementos mais comuns são oxigênio (O) e nitrogênio (N) que juntamente com o H formam os elementos organógenos.
Outros elementos comumente encontrados em compostos orgânicos são os halogênios flúor (F), cloro (Cl), bromo (Br) e iodo (I).
Veja abaixo algumas ligações possíveis para o carbono.
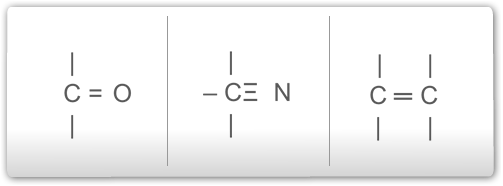
Vejamos abaixo, as valências dos principais elementos químicos que fazem ligações com o carbono:
Elemento
Z*
Grupo
DistribuiÇÃo em nÍveis
ValÊncia livre
RepresentaÇÃo
Hidrogênio
1
1
K1
1(monovalente)
H-
Carbono
6
14
K2 L4
4 (tetravalente)
-C- =C= -C= -C≡
Nitrogênio
7
15
K2 L5
3 (trivalente)
-N- ou – N= ou N≡
Fósforo
15
15
K2 L8 M5
3 (trivalente)
-P- ou – P ou P≡
Oxigênio
8
16
K2 L6
2 (bivalente)
-O- ou O =
Enxofre
16
16
K2 L8 M6
2 (bivalente)
-S- ou S=
Flúor
9
17
K2 L7
1(monovalente)
F-
Cloro
17
17
K2 L8 M7
1(monovalente)
Cl-
Bromo
35
17
K2 L8 M18 N7
1(monovalente)
Br-
Iodo
53
17
K2 L5 M18 N18 O7
1(monovalente)
I-
Magnésio
12
2
K2 L8 M2
2 (bivalente)
Mg 2+
Zinco
30
12
K2 L8 M18 N2
2 (bivalente)
Zn2+
*Z= número atômico
- O carbono forma cadeias (terceiro postulado de Kekulé)
O átomo de carbono tem uma capacidade extraordinária de ligar-se a outros átomos – de carbono, de oxigênio, de nitrogênio e etc. – formando encadeamentos ou cadeias, curtas ou longas, com as mais variadas disposições. Apesar de existirem outros elementos que conseguem formar encadeamentos, nenhum elemento químico apresenta a capacidade de formar cadeias tão longas, variadas e estáveis como o carbono. Essas características, juntamente com as anteriores, explicam o fato de o carbono ser capaz de formar um número enorme de compostos. Vejamos alguns exemplos abaixo: