Teoria de hibridação dos orbitais
Orbital molecular é a região em torno dos núcleos de maior probabilidade de ser encontrado o par eletrônico compartilhado. Há dois tipos de orbital molecular:
Orbital Molecular σ (sigma), ou simplesmente ligação
, é aquele formado na interpenetração de orbitais atômicos segundo um eixo.
Orbital Molecular π, ou simplesmente ligação π, é aquele formado na interpenetração de orbitais atômicos exclusivamente segundo os eixos paralelos.
Teoria da hibridação dos orbitais
Para exemplificar essa teoria, vamos utilizar o elemento carbono:
O átomo de carbono, em seu estado fundamental, apresenta a seguinte configuração eletrônica para seus orbitais:
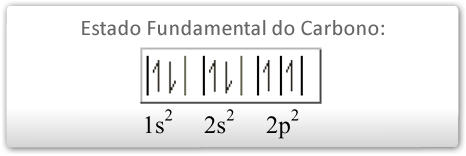
Por esse esquema podemos perceber que há elétrons emparelhados no subnível 1s2 e no 2s2. Sendo assim, só seria possível para o carbono estabelecer duas ligações, uma vez que existem apenas dois elétrons desemparelhados. Experimentalmente, porém, verificou-se que o carbono faz sempre quatro compartilhamentos eletrônicos, e não dois, como era de se esperar. Como explicar isso?
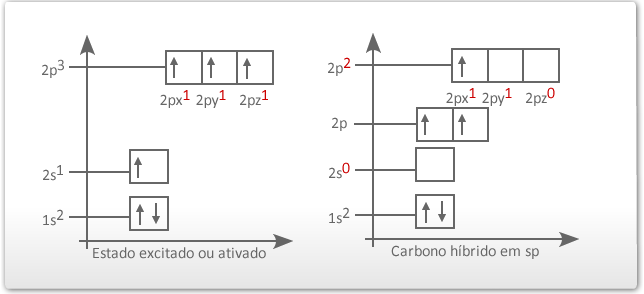
Para explicar esse fato, na década de 1930, surgiu a teoria da hibridação dos orbitais, que não se aplica exclusivamente ao átomo de carbono, mas merece destaque para ele, pois o carbono apresenta vários tipos de hibridação. O termo hibridação se refere à alteração das formas dos orbitais 2s (esférica), 2px, 2py e 2pz (halteres). A partir da sua configuração eletrônica no estado fundamental, o carbono promove um dos elétrons do orbital 2s para o orbital 2pz, que estava "vazio", passando agora para um estado ativado. Veja:
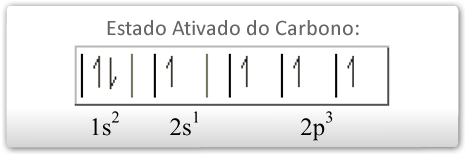
No estado ativado, o carbono pode sofrer três tipos de hibridação, dependendo dos tipos de ligação que ele estabelecerá com outros átomos: hibridação sp3, sp2 e sp.
HIBRIDAÇÃO SP3 DO CARBONO
O elétron do orbital do subnível 2s ganha energia e passa a ocupar um orbital mais energético, e os elétrons dos orbitais 2px, 2py e 2pz do subnível p perdem energia e passam a ocupar cada um deles, orbitais de menor energia (comparar o quadro da esquerda com o quadro da direita na figura abaixo). Os quatro orbitais híbridos são denominados de sp3, ou seja, um orbital híbrido formado a partir de um orbital s e três orbitais p, sendo assim, os elétrons passam a ter a mesma energia. Esse tipo de hibridação existe no carbono que faz quatro ligações simples, ou seja, quatro ligações δ (sigma).
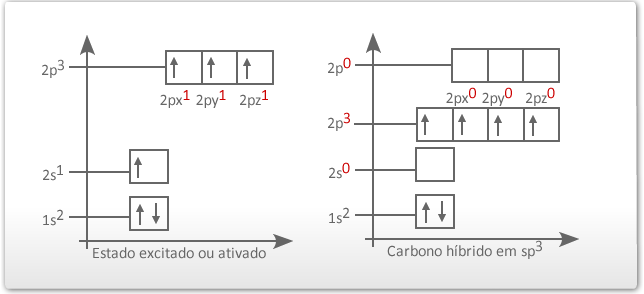
1º. Tipo: Hibridação tetraédrica ou sp3- veja que o antigo orbital 2s se uniu aos orbitais 2p, formando 4 orbitais sp3 semipreenchidos.
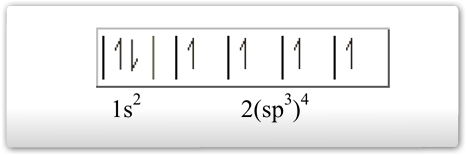
Assim, o carbono poderá efetuar quatro ligações sigma. O carbono de faz quatro ligações sigma tem geometria tetraédrica, devido ao ângulo de afastamento entre os pares eletrônicos dos quatro orbitais sp3. Os elementos da família do carbono (silício e germânio) também formam moléculas através desse tipo de hibridação. A configuração espacial do carbono híbrido em sp3 é tetraédrica (figura da direita), apresenta 4 (quatro) orbitais híbridos com ângulos de 109º 28´.
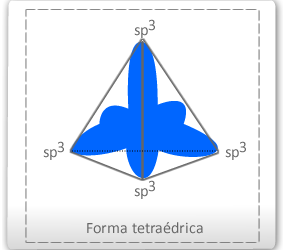
Resumindo, podemos dizer que o carbono que apresenta 4 ligações: todas simples ou seja, (4 ligações δ) realizando hibridação do tipo sp2, com geometria tetraédrica. Trata-se de um carbono "saturado”, ou seja, não apresenta ligações duplas ou triplas
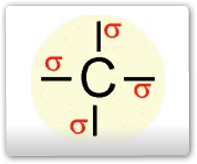
HIBRIDAÇÃO SP2 DO CARBONO
O elétron do orbital do subnível 2s ganha energia e passa a ocupar um orbital mais energético, e os elétrons dos orbitais 2py e 2pz do subnível p perdem energia e passam a ocupar cada um deles, orbitais de menor energia (comparar o quadro da esquerda com o quadro da direita na figura abaixo). Os três orbitais híbridos são denominados de sp2 e os elétrons passam a ter a mesma energia. O elétron que permaneceu no orbital 2px é chamado de "p puro" e possui energia superior a dos orbitais híbridos.
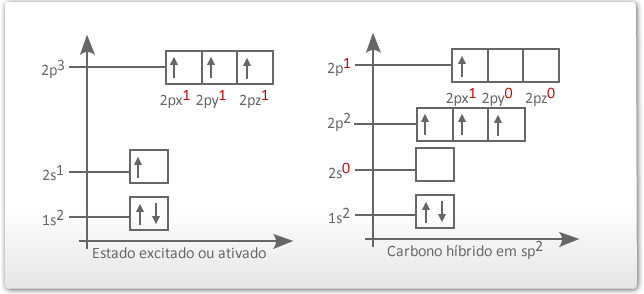
2º tipo: Hibridação trigonal plana ou sp2 - o orbital 2s se uniu aos orbitais 2p, formando 3 orbitais sp2 e um orbital p semipreenchidos
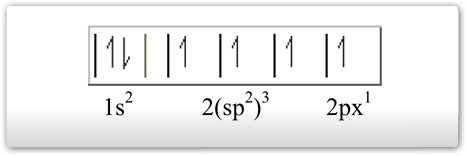
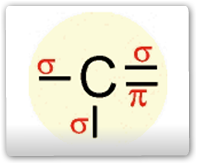
Esse tipo de hibridação é específico do carbono que faz uma dupla ligação. Logo, terá, logicamente, três ligações simples (δ) e uma ligação π (pi) – do orbital "p puro" –, configurando ao carbono a hibridação do tipo sp2, ou seja, um orbital híbrido formado a partir de um orbital s e dois orbitais p. Assim, o carbono poderá efetuar três ligações δ e uma ligação π. A configuração espacial do carbono híbrido em sp2 é TRIGONAL PLANA (figura abaixo), apresentando 3 orbitais híbridos no plano trigonal e 1 orbital perpendicular ao plano trigonal que corresponde ao orbital "p puro". Sendo assim o ângulo ente os orbitais híbridos é de 120º.
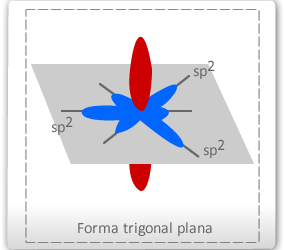
Resumindo: o carbono apresenta 4 ligações: 3 ligações δ e 1 ligação π, realiza hibridação do tipo sp2, com geometria trigonal plana. Tata-se de um carbono "insaturado", ou seja, apresenta ligação dupla.
HIBRIDAÇÃO SP DO CARBONO
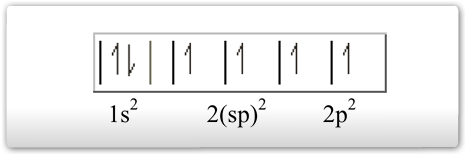
O elétron do orbital do subnível 2s ganha energia e passa a ocupar um orbital mais energético, e os elétrons dos orbitais 2pz do subnível p perde energia e passam a ocupar um orbital de menor energia (comparar o quadro da esquerda com o quadro da direita). Os dois orbitais híbridos são denominados de sp, ou seja, um orbital híbrido formado a partir de um orbital s e um orbital p e os elétrons passam a ter a mesma energia. Os elétrons que permanecem nos orbitais 2px e 2py são chamados de “p puro” e possuem energia superior a dos orbitais híbridos.
3º tipo: Hibridação linear plana ou sp- o orbital 2s se uniu aos orbitais 2p, formando 2 orbitais sp e dois orbitais p semipreenchidos.
Esse tipo de hibridação é específico do carbono que faz duas duplas ligações ou uma ligação tripla, como na figura abaixo
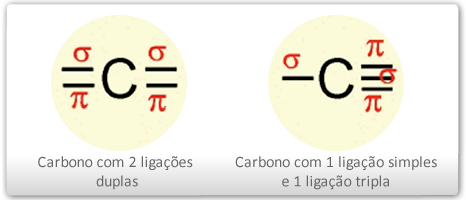
O carbono que apresenta duas ligações duplas terá, logicamente, duas ligações (δ) e duas ligações π (pi) – dos orbital "p puros", já o carbono com ligação tripla ligação terá duas ligações (δ) e duas ligações π (pi) – dos orbital "p puros", configurando ao carbono a hibridação do tipo sp2. Assim, o carbono poderá efetuar três ligações δ e uma ligação π. A configuração espacial do carbono híbrido em sp é LINEAR PLANA (figura ao lado), apresentando 2 orbitais híbridos no plano linear e 2 orbitais perpendiculares ao plano linear e perpendiculares entre si correspondente aos orbitais "p puro". Sendo assim, o ângulo entre os orbitais híbridos é de 180º.
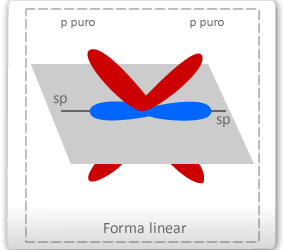
Resumindo: Ambos os carbonos apresentam 4 ligações: 2 ligações δ e 2 ligação π (no carbono de dupla ligação ou de tripla ligação). Realizam hibridação sp, com geometria linear plana. Trata-se de carbonos "insaturados" devido às ligações duplas e triplas.
