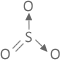
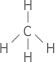
Introdução
Nessa unidade iremos compreender um pouco da estrutura e propriedades físicas dos compostos orgânicos de forma sintética. Bom, como você acha que os químicos esboçam a maneira com os núcleos dos átomos se encontram posicionados um em relação aos outros no espaço? Se você respondeu que isso depende de uma geometria, acertou. Só que em Química, denominamos de geometria molecular ou geometria da molécula.
E como fazer para prever essa geometria da molécula? Para isso, foi elaborado um método pelos químicos ingleses Nevil Sidgwich e Herbert Powell e aperfeiçoados pelo canadense Ronald Gillespie, que se baseia no MODELO DE REPULSÃO DOS PARES ELETRÔNICOS DA CAMADA DE VALÊNCIA (abreviado pela sigla de origem inglesa VSEPR, de valence-shell eléctron-pair repulsion).
Observe nos desenhos abaixo, algumas moléculas bem comuns, onde foram dispostas no espaço para entender a geometria molecular.
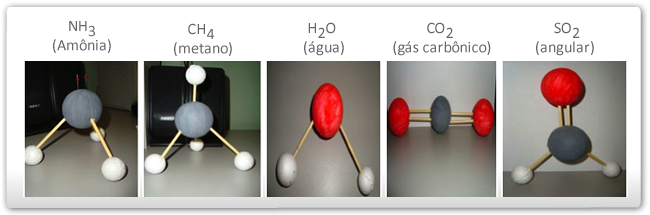
Se uma molécula é diatómica, não é difícil prever a sua geometria: ela é, necessariamente, linear. Mas se uma molécula se compõe de 3 ou mais átomos, a geometria molecular, ou seja, o arranjo espacial dos átomos na molécula, já não é imediatamente previsível. Esse arranjo será sempre determinado pelo facto de que a energia da molécula deve ser minimizada, isto é, a geometria adoptada será aquela que torna a molécula mais estável (princípio da energia mínima).
A VSEPR ou TRECV é um modelo muito simples, que permite prever a geometria de moléculas ou ions poliatómicos: baseia-se em que, se a geometria de uma molécula é a que lhe confere a energia mínima, então será aquela a que corresponde a menor repulsão entre os pares electrónicos que existem na camada de valência do(s) seu(s) átomo(s) central (centrais) (uma molécula poderá ter um ou mais átomos centrais). Esses pares de eletrons vão dispor-se à volta do átomo central de modo a estarem o mais afastados possível uns dos outros, para minimizarem as repulsões electrónicas.
A geometria de uma molécula depende do número de átomos participantes e, quando existe um átomo central, da quantidade de elétrons não envolvidos em ligações na última camada deste (os elétrons exercem repulsão entre si). As ligações covalentes são formadas por pares de elétrons. Ocorre então repulsão entre ligações , entre elétrons livres e entre ligações e elétrons livres.
Vamos ver o caso das geometrias principais de algumas moléculas:
Moléculas com dois átomos iguais ou diferentes (diatômicas) - O2, HCl...
O = O |
H - Cl |
A molécula será invariavelmente linear. O ângulo entre as ligações será de 180º.
Exemplos:
Moléculas com três átomos (triatômicas)
- Na ausência de elétrons não envolvidos em ligações na última camada do átomo central: a molécula é invariavelmente linear. O ângulo entre as ligações será de 180º.
HCN, CO2...H - C º N
O = C = O
Exemplos:
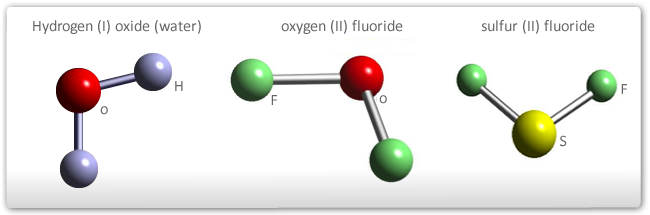
- Na presença de par ou pares de elétrons não envolvidos em ligações na última camada do átomo central: os elétrons livres repelem os eixos das ligações e a molécula será angular. O ângulo entre as ligações será tanto menor quanto maior for o número de elétrons não envolvidos em ligações na última camada do átomo central. O ângulo para o H2O vale 105º.
Exemplos:
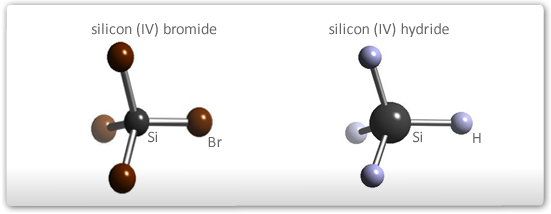
Moléculas com quatro átomos
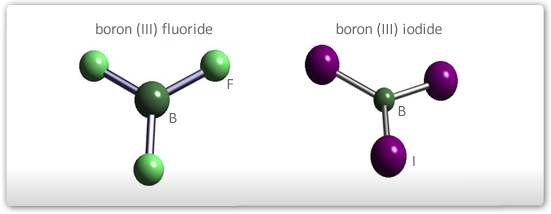
- Na ausência de par de elétrons não envolvido em ligação na última camada do átomo central: a molécula terá todos os átomos no mesmo plano de três lados (trigonal plana). Os ângulos serão de 120º entre as ligações.
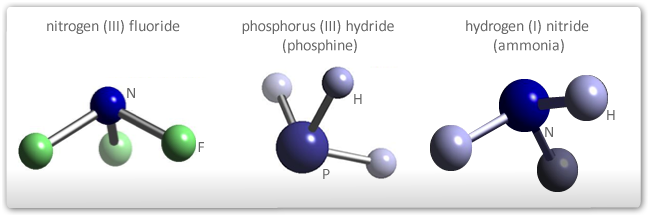
- Na presença de par ou pares de elétrons não envolvidos em ligação na última camada do átomo central: o par de elétrons exerce repulsão sobre os eixos de ligação e distorce a estrutura trigonal plana para uma pirâmide de base piramidal ou pirâmide trigonal (03 lados). Para o NH3, o ângulo vale 107.
Exemplos:
Moléculas com cinco átomos
As quatro ligações se distribuirão no espaço de maneira a diminuir ao máximo a repulsão entre elas e a estrutura será um tetraedro com o átomo central ocupando o centro do sólido geométrico.
Exemplos: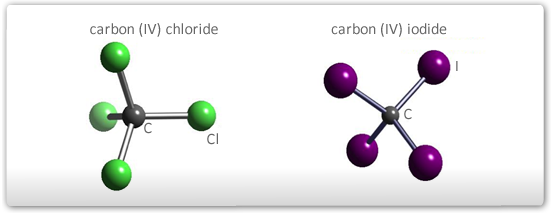
GeOMETRIA MOLECULAR |
||||
NÚMERO TOTAL DE PARES ELTRÔNICOS (NUVENS) AO REDOR DO ÁTOMO CENTRAL |
DISPOSIÇÃO DOS PARES ELTRÔNICOS (NUVENS) |
NÚMERO DE ÁTOMOS LIGADOS AO ÁTOMO CENTRAL |
GEOMETRIA MOLECULAR |
EXEMPLOS |
| 2 | 2 | Linear |
CO2
|
|
| 3 |  |
2 | 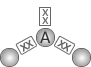 Angular |
SO2
|
| 3 | 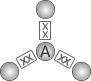 Trigonal ou Triangular |
SO3
|
||
| 4 |  |
2 | 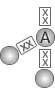 Angular |
H2O
|
| 3 | 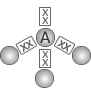 Piramidal |
NH3
|
||
| 4 | 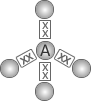 Tetraédrica |
CH4
|
||
Observação: Uma dativa (→) ou uma dupla (=) ou uma tripa(≡) correspondem a uma nuvem.
Fonte: Usberco & Salvador, 2010
Polaridade das Ligações e das Moléculas
As ligações C-C e C-H, são consideradas ligações com pouca ou nenhuma diferença de eletronegatividade entre os átomos ligados. Muitos destes grupos funcionais contêm átomos de eletronegatividade diferentes. Se for considerada a molécula do gás hidrogênio (H2), onde dois átomos de hidrogênio compartilham um par de elétrons, tem-se este par sendo atraído com a mesma intensidade pelos dois núcleos. O mesmo acontece no caso da molécula de cloro. Nestes casos temos a ligação covalente apolar. Por outro lado, quando átomos diferentes estão ligados, nem sempre este compartilhamento será feito de forma simétrica. O átomo com maior eletronegatividade, puxa o par de elétrons para si, resultando em uma ligação covalente polar.
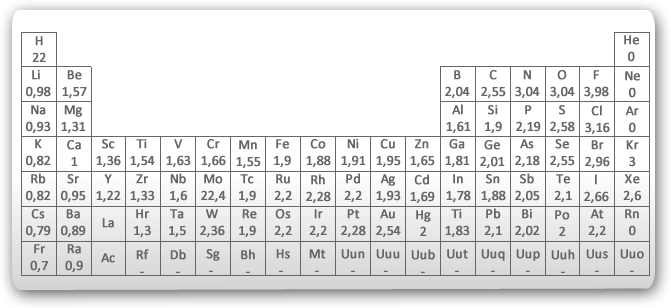
Veja os valores abaixo:
Exemplo:
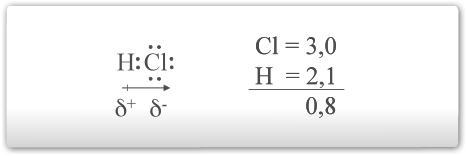
Como o átomo de cloro possui uma eletronegatividade maior, puxa os elétrons para si. Isso torna o átomo de hidrogênio deficiente de elétrons e dá a ele uma carga positiva e uma carga negativa ao cloro.
A molécula com extremidades com cargas é uma molécula com dipolo e que possui um momento de dipolo (m).
De maneira geral:
- As ligações entre átomos com valores de eletronegatividade próximos são ligações covalentes apolares.
- igações entre átomos cujos valores de eletronegatividade diferem menos de duas unidades são ligações covalentes polares.
- Ligações entre átomos cujos valores diferem de duas ou mais unidades são iônicas.
Até o momento, a ligação covalente foi definida como sendo o compartilhamento de elétrons entre dois núcleos, sem levar-se em conta a natureza deles. Existe, no entanto, diferenças marcantes neste compartilhamento.
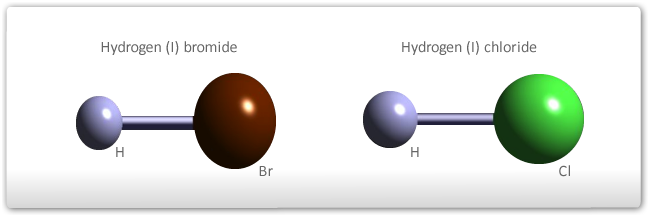
Se for considerada a molécula do hidrogênio, onde dois átomos de hidrogênio compartilham um par de elétrons, tem-se este par sendo atraído com a mesma intensidade pelos dois núcleos. O mesmo acontece no caso da molécula de cloro. Por outro lado, quando átomos diferentes estão ligados, nem sempre este compartilhamento será feito de forma simétrica. Por exemplo, considere-se a molécula do ácido clorídrico. Nesta molécula tem-se um átomo de hidrogênio ligado a um átomo de cloro, sendo o par de elétrons atraído por ambos os núcleos. A grande diferença na eletronegatividade destes átomos resulta numa maior força de atração do par de elétrons pelo núcleo de cloro. Desta maneira, a nuvem eletrônica que forma a ligação estará distorcida, gerando uma falta de elétrons (ou carga parcial positiva) em torno ao hidrogênio e um excesso deles (ou carga parcial negativa) em torno ao cloro.
Pode-se então classificar as ligações covalentes em dois tipos: aquelas onde a nuvem eletrônica não está polarizada, formada com átomos com eletronegatividades semelhantes, e aquelas onde ela encontra-se polarizada, no caso de núcleos com eletronegatividades marcadamente diferentes. Estes dois tipos de ligação covalente são conhecidos como ligação polar e apolar.
Como resultado da polarização de ligações covalentes, tem-se a formação de dipolos elétricos. No caso do ácido clorídrico, pode-se representar a formação deste dipolo elétrico conforme a figura abaixo.
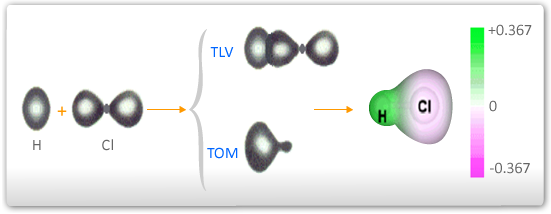
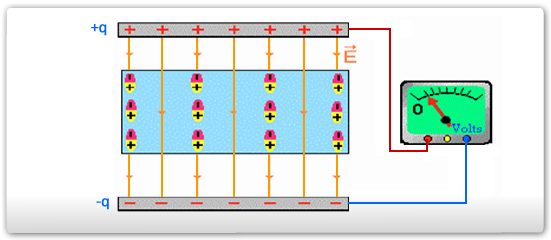
A formação de dipolos elétricos em moléculas, como no caso do HCl, pode facilmente ser verificado experimentalmente. Ao aplicar um campo elétrico, as moléculas irão girar de forma a alinhar-se com este campo, conforme mostrado no esquema abaixo.
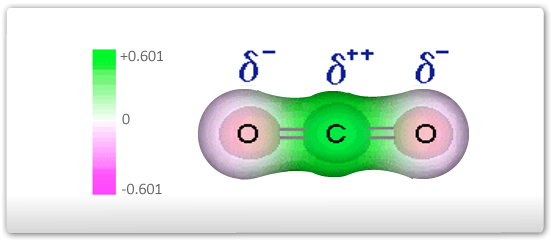
Considere-se, por exemplo, a molécula do CO2. Neste composto, o carbono apresenta duas ligações com cada oxigênio, uma através de um orbital híbrido do tipo sp e a outra com um orbital p puro. Desta maneira, a geometria da molécula é linear, com ângulo de 180º entre as duplas ligações. Dada a maior eletronegatividade do oxigênio em relação ao carbono, serão formados nesta estrutura dois dipolos elétricos, conforme o esquema abaixo. Se os vetores que representam estes dipolos forem somados, ver-se-á que a resultante é nula. Em outras palavras, a molécula do CO2 , mesmo sendo formada por ligações polares, será apolar.
Na molécula da água, H2O, o átomo de oxigênio possui uma hibridização do tipo sp3, onde dois orbitais híbridos estão com um par de elétrons e os outros dois formam ligações com átomos de hidrogênio. A geometria da molécula é então triangular planar, com um ângulo de 104,5º. Dois dipolos são então formados devido a grande diferença de eletronegatividade entre estes dois átomos. O somatório destes dipolos não é nulo, o que significa que a molécula da água apresenta uma polaridade resultante, conforme pode ser visualizado no esquema abaixo.
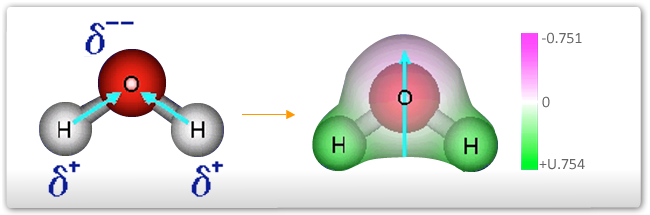
O somatório dos momentos de dipolo são realizados utilizando vetores. Para tal, deve-se transpor todos os vetores que representam os dipolos elétricos existentes na molécula, mantendo-se a inclinação original, de tal forma que o início de um coincida com o final do outro. O vetor somatório, que representa a polarização resultante na molécula, é então obtido unindo-se o início do primeiro vetor da soma com o final do último. Na figura abaixo, esta operação é exemplificada para a molécula da água.
Para prever a polaridade da molécula, podemos o-relacionar, com o seguinte esquema apresentado abaixo:
| POLARIDADE DAS MOLÉCULAS | ||||
| Número de pares eletrônicos (nuvem) ao redor do átomo central | Igual ao | Número de ligantes iguais | ||
Exemplo: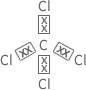 |
4 pares eletrônicos e 4 ligamentos iguais | Molécula simétrica | Molécula apolar | |
| Nº de pares eletrônicos (nuvens) ao redor do átomo central | é diferente de | Número de ligantes iguais | ||
Exemplo: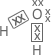 |
4 pares eletrônicos e 2 ligantes iguais | Molécula assimétrica | Molécula polar | |