Forças de Interação Intermoleculares
A primeira observação que certamente fazemos em qualquer trabalho experimental é se uma certa substância é um sólido, um líquido ou um gás. A solubilidade de um composto e as temperaturas nas quais ocorrem transições entre fase, isto é, pontos de fusão (pf) e pontos de ebulição (pe) também estão entre as propriedades físicas mais facilmente medidas.
Essas propriedades físicas simples, podem nos ajudar a identificar ou até mesmo isolar diversos compostos orgânicos. Um exemplo é a destilação do álcool, em que o etanol (ponto de ebulição de 78ºC) pode ser separado de uma solução aquosa através de um aquecimento controlado (destilação).
As constantes físicas, que ajudam a separar e caracterizar os inúmeros compostos orgânicos pode ser encontrado facilmente na literatura.
Quando uma substância é desconhecida, iniciamos os estudos realizando estimativas destas propriedades físicas macroscópicas podemos estimar qual será a estrutura mais provável das substâncias e nas forças que atuam entre as moléculas e os íons. Podemos citar algumas forças que influenciam estas propriedades físicas como a força íon-dipolo, forças de dipolo-dipolo, ligações de hidrogênio, forças de Van der Walls (ou forças de london).
- Forças íon-dipolo: quando um dipolo elétrico, por exemplo a molécula da água, sofre influência do campo elétrico gerado por um íon, por exemplo o cátion de sódio, ele irá alinhar-se ao campo e manter-se unido a fonte geradora. Ou seja, neste caso, o oxigênio da água, onde está localizada a carga parcial negativa, une-se ao cátion de sódio e os hidrogênios afastam-se o máximo possível, conforme mostrado abaixo.
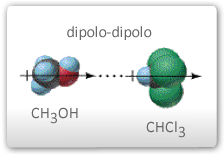
- Forças dipolo-dipolo: quando duas moléculas polares, como o metanol e Clorofórmio, se aproximam, surgem forças de atração eletrostática entre elas. É importante notar que estas forças são direcionais, orientando os dipolos espacialmente, como mostrado na figura abaixo.
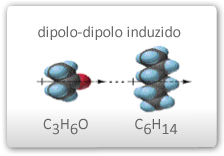
- Forças dipolares induzidas: quando uma molécula apolar se aproxima a outra polar, ocorre uma distorção da sua nuvem eletrônica gerando um dipolo elétrico. Entre este dipolo formado, conhecido como dipolo induzido, e o indutor, ocorre então o surgimento de forças de atração semelhantes às verificadas entre moléculas polares. Na figura abaixo, este processo de indução aparece esquematizado.
-
Forças de London ou Forças de Van der Walls ou forças de dispersão: este tipo de interação surge entre moléculas apolares. Admite-se que a interação originada pela aproximação destas espécies leva a formação de dipolos induzidos, os quais irão se atrair mutuamente. Este tipo de força também é conhecida como dispersão. Se considerarmos uma substância como o metano, cujas partículas são moléculas apolares, veremos que o ponto de fusão e ebulição são muito baixo: -182,6 ºC e -162 ºC, respectivamente. Em vez de perguntar “porque metano funde ou evapora a temperaturas tão baixas” a pergunta mais apropriada seria “por que o metano, uma substância não iônica e apolar, pode tornar-se um líquido ou um sólido?” A resposta é porque existem forças intermoleculares atrativas chamadas forças de Van der Walls (ou London).
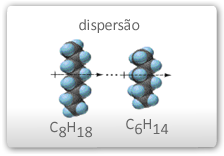
Devido à movimentação dos elétrons estes podem gerar um pequeno dipolo temporário que podem induzir dipolos opostos em moléculas vizinhas. Tais dipolos temporários alteram-se constantemente, mas o resultado final de sua existência é produzir forças atrativas entre moléculas apolares e assim tornar possível a existência nos estados líquidos e sólidos.
- Ligações de Hidrogênio: As ligações de hidrogênio (ou Ponte de Hidrogênio) são difíceis de serem definidas, uma vez que são bem mais fortes que as forças de van der Walls, porém mais fracas que uma ligação de valência. Pode-se dizer que, quando ligado a um grupo fortemente eletronegativo (A), como os átomos de flúor (F), oxigênio (O) e nitrogênio (N), o hidrogênio pode apresentar uma segunda ligação, mais fraca que a anterior, com um segundo átomo (B). Esta segunda ligação é dita então ligação de hidrogênio, e é representada com um traço descontínuo, como mostrado na figura abaixo.
A-H .......B
São conhecidas ligações de hidrogênio formadas com átomos pertencentes a outra molécula, como as verificadas na água pura ou na solução de metanol em água, como ilustrado abaixo.
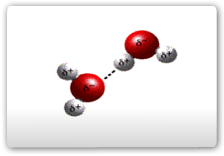
Pontes de Hidrogênio entre as moléculas de água
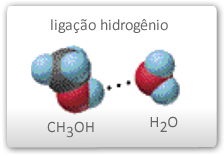
Pontes de Hidrogênio entre moléculas de metanol e água
A ligação hidrogênio é mais fraca que uma ligação covalente comum, porém muito mais forte do que as interações dipolo-dipolo que ocorrem na acetona.

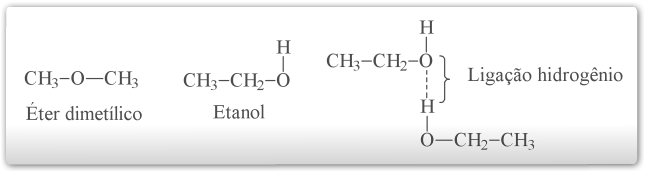
A ligação de hidrogênio é responsável pelo fato de o álcool etílico ter um ponto de ebulição muito mais elevado (+78,5 ºC) que o do éter dimetílico (-24,9 ºC), apesar de ambos possuírem o mesmo peso molecular. As moléculas do álcool etílico podem formar ligações hidrogênio muito fortes entre si, já que apresentam um átomo de hidrogênio ligado covalentemente a um átomo de oxigênio. As moléculas do éter dimetílico, por não terem átomo de hidrogênio ligado a um átomo fortemente eletronegativo, não podem formar ligação hidrogênio uma com as outras. No éter dimetílico as forças intermoleculares são interações dipolo-dipolo mais fracas.
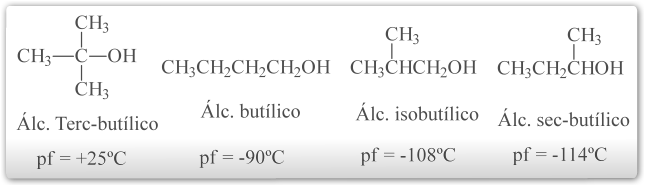
Outro fator (além da polaridade e ligação de hidrogênio) que afeta o ponto de fusão de muitos compostos orgânicos é a compactação e a rigidez de suas moléculas individuais. Moléculas simétricas geralmente possuem pontos de fusão anormalmente elevados.
PROPRIEDADES FÍSICAS
As propriedades físicas dos compostos orgânicos podem ser interpretadas, e muitas vezes até previstas, a partir do conhecimento das ligações químicas que unem os átomos de suas moléculas e das forças que agem entre elas, chamadas de forças intermoleculares. Elas também permitem identificar as substâncias e determinar suas aplicabilidades. Daremos ênfase as seguintes: ponto de ebulição (PE ou TE), ponto ou temperatura de fusão (PF ou TF), solubilidade, densidade e viscosidade
Temperatura de ebulição
Quanto mais fortes forem as ligações intermoleculares, mais elevada será a temperatura de ebulição.
Quanto mais “esférica” for a molécula, menor será seu ponto de ebulição, já que as forças de Van der Waals são mais eficientes quanto maior for a superfície de contato.
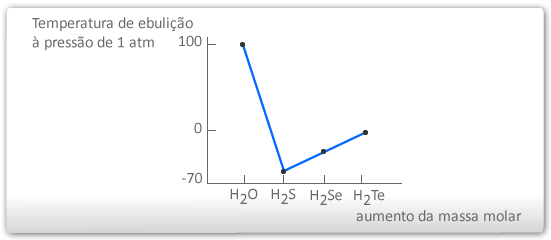
- A água tem comportamento excepcional quando comparado aos pontos de ebulição de substâncias moleculares semelhantes.
- Podemos notar que, caso a água mantivesse a linearidade do gráfico, sendo essa linearidade ditada pela massa molecular dos compostos da mesma família, teria um ponto de ebulição próximo de - 100º C!
- Temperatura de fusão: As substâncias iônicas tem T.F , T.E elevados e são geralmente sólidas porque os cátions e os ânions se atraem fortemente e a dificuldade de afastar os cátions e os ânions se traduz na dificuldade de fundir e de ferver as substâncias iônicas.
Pelo contrário, as substâncias orgânicas são em geral covalentes e frequentemente apolares; em consequência tem T.F e T.E. baixos e são geralmente líquidos ou gases.
- Solubilidade das substâncias:
Para prever a solubilidade As forças intermoleculares são de importância vital para explicar as solubilidades das substâncias.
Solubilidade nada mais é que a quebra das ligações químicas que compõe o sólido, retirando de um arranjo ordenado para um desordenado em que o composto tem uma interação como o solvente.
Exemplo: Substância iônica sofre um hidratação (água) ou solvatação (outro solvente).

De modo geral podemos dizer que iguais dissolvem iguais, compostos polares são dissolvidos em solventes polares e vice-versa. Porém a estrutura irá definir também a solubilidade.
Exemplo: O etanol é miscível em qualquer proporção com a água devido as pontes de hidrogênio, já o decanol (álcool com 10 carbonos) é pouco solúvel, devido a sua estrutura possuir uma parte hidrofóbica, ou seja pouco polarizada.
Os químicos orgânicos definem usualmente um composto solúvel em água se pelo menos 3 g do composto se dissolvem em 100 ml de água (3% m/v).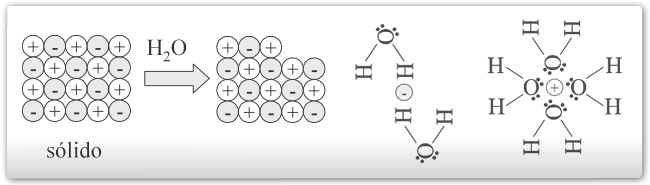
- compostos com 1 a 3 átomos de carbono são solúveis;
- Compostos com 4 a 5 átomos de carbono estão no limite da solubilidade;
- Compostos com mais de 6 átomos são insolúveis.
Essas regras não se aplicam quando um composto contém mais de um grupo hidrofílico. Os polissacarídeos, as proteínas e os ácidos nucléicos contêm milhares de átomos de carbono e são todos solúveis. Porque eles possuem também milhares de grupos hidrofílicos.
Casos importantíssimos de solubilidade:
- Hidrocarbonetos
- Quanto maior o n.º de Carbonos maior o PM (peso molecular) , maior o PF (ponto de fusão) e PE (ponto de ebulição) ( maior a FVW )
- Dois hidrocarbonetos de mesmo nº de C , quanto menos ramificada , maior a superfície de contato, maior a FVW, maior PF e PE.
- Não são polares, não são solúveis em água ( ou são pouco solúveis), são solúveis em solventes orgânicos.
- São menos denso que a água.
- PF e PE dos compostos cíclicos são maiores que dos não cíclicos.
- PE e PF dos alcenos são maiores que dos alcanos correspondentes.
- Álcoois
- Formam pontes de Hidrogênio entre si (tem - OH)
- Quanto maior o PM maior o PE ( maior a FVW).
- PE (álcool) > PE (Hidrocarboneto correspondente) (devido às pontes de Hidrogênio)
- Quanto maior o PM , menor a solubilidade em água (os primeiros álcoois são solúveis em água pois são polares e formam pontes de Hidrogênio c/ a água).
- Éteres
- Não formam pontes de Hidrogênio entre si (só tem força dipolo-dipolo).
- ( R - O - R ) por isso tem baixo PE e PF.
- Quanto maior o PM, maior PE ( maior FVW)
- Muito pouco solúveis em água (devido à força dipolo)
- PE (álcool) > PE (éter) > PE (Hidrocarboneto de PM correspondente) ( pontes de H )
- Ácidos Carboxílicos
- ( - COOH ) são polares (tem FVW, força dipolo e pontes de H entre si e com a água)
- Os 4 primeiros ácidos são solúveis em água devido à polaridade e às pontes de H
- PE (ácidos) > PE (álcoois) > PE (aldeídos e cetonas) > PE (éter) > PE (Hidrocarboneto Correspondente)
- Aldeídos e Cetonas
- (C = O) são polares (força dipolo-dipolo)
- Aldeídos e Cetonas de baixo PM são solúveis em água (os outros são insolúveis)
- PE (álcoois) > PE (aldeídos e cetonas) > PE (Hidrocarboneto Correspondente) ( pontes de H ) ( força dipolo ) ( FVW )
- Ésteres e Cloretos de Ácidos
- São compostos polares (força dipolo)
- Tem PE próximos ao PE dos aldeídos e cetonas correspondentes Amidas e Aminas
- São polares pois formam pontes de H ( entre o N e o H ) , são solúveis em água.
- Densidade
- As substâncias Orgânicas são, em geral pouco densas (tem densidade menor que da água) por este motivo quando insolúveis em água essas substâncias formam uma camada que "flutua" sobre a água, como acontece com a gasolina, o éter comum , o benzeno, etc.
- Substâncias orgânicas contendo um ou mais átomos de massas atômicas elevadas podem ser mais densas que a água , exemplo CHBr3 é três vezes mais denso que a água.
- Viscosidade
- Quanto maior a polaridade de uma molécula, maior será sua viscosidade
Comparando a gasolina e a glicerina:
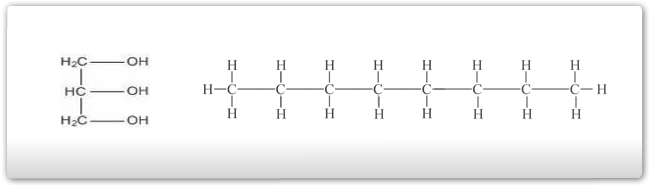
A glicerina apresenta:
- Maior polaridade
- Maior temperatura de ebulição
- Maior solubilidade em água
- Menor volatilidade
- Maior viscosidade