Síntese
Propriedades físicas dos compostos orgânicos
Os fatores principais que determinam as propriedades físicas e químicas dos compostos orgânicos são :
- Polaridade da moléculas (polar ou apolar)
- Cadeia carbônica (normal ou ramificada)
- Massa molar (M)
Geometria da Molécula
GeOMETRIA MOLECULAR |
||||
NÚMERO TOTAL DE PARES ELTRÔNICOS (NUVENS) AO REDOR DO ÁTOMO CENTRAL |
DISPOSIÇÃO DOS PARES ELTRÔNICOS (NUVENS) |
NÚMERO DE ÁTOMOS LIGADOS AO ÁTOMO CENTRAL |
GEOMETRIA MOLECULAR |
EXEMPLOS |
| 2 | 2 | Linear |
CO2
|
|
| 3 |  |
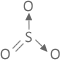
2 |  Angular |
SO2
|
| 3 |  Trigonal ou Triangular |
SO3
|
||
| 4 |  |
2 | 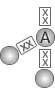 Angular |
H2O
|
| 3 | 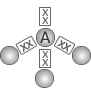 Piramidal |
NH3
|
||
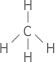
| 4 | 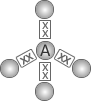 Tetraédrica |
CH4
|
||
Polaridade da moléculas
Moléculas apolares se unem por forças de atração fracas conhecidas por vários nomes:
- Força de van der Waals
- Força de London
- Força dipolo induzido-dipolo instantâneo
- Dipolo induzido-dipolo induzido
Possuem baixo ponto de fusão e ebulição e são insolúveis em água.
Moléculas polares se unem por dois tipos de força de atração distintas:
- Dipolo-dipolo ou dipolo permanente-dipolo permanente ou
- Ponte de hidrogênio (H – FON)
Possuem pontos de fusão e ebulição mais elevados e são solúveis em água.
Dentre essas forças, a mais forte é a Ponte de Hidrogênio, seguida pelo dipolo-dipolo e a força mais fraca é a de Van der Waals.

A polaridade de um composto orgãnico depende da sua geometria e de suas ligações. É difícil determinar a geometria de uma molécula orgânica devido à presença de cadeias carbônicas. De um modo geral dizemos que:
- Hidrocarbonetos são apolares
- Presença de OH (ácidos, fenóis e álcoois)e NH (aminas) são muito polares devido às Pontes de Hidrogênio formadas.
- Em geral os demais compostos são polares, guardadas as devidas particularidades.
Massa molar

Cadeia carbônica
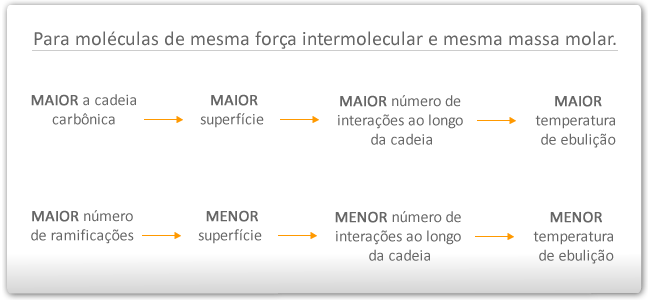
Resumindo
- Para moléculas com tamanhos aproximadamente iguais, a TF e TE dependerá da interação (força) intermolecular.
- Para moléculas com o mesmo tipo de interação, a TF e TE dependerá da massa molar.
- Para moléculas de mesma interação e massa molar iguais (isômeros), a TF e TE dependerá do tipo da cadeia carbônica.
Solubilidade de compostos orgânicos
Regra geral
“Semelhante dissolve semelhante”.
Água (H2O) e amônia (NH3) são polares.
Hidrocarbonetos, óleos e graxas são apolares.
Álcoois de até 3 carbonos possuem solubilidade infinita em água, pois são polares e interagem por pontes de hidrogênio.