Isomeria Óptica
Isomeria óptica estuda o comportamento das substâncias quando submetidas a um feixe de luz polarizada, que pode ser obtida a partir da luz natural.
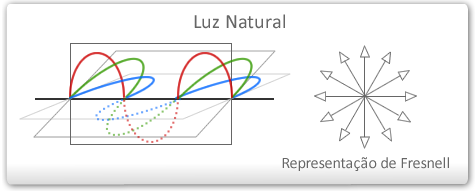
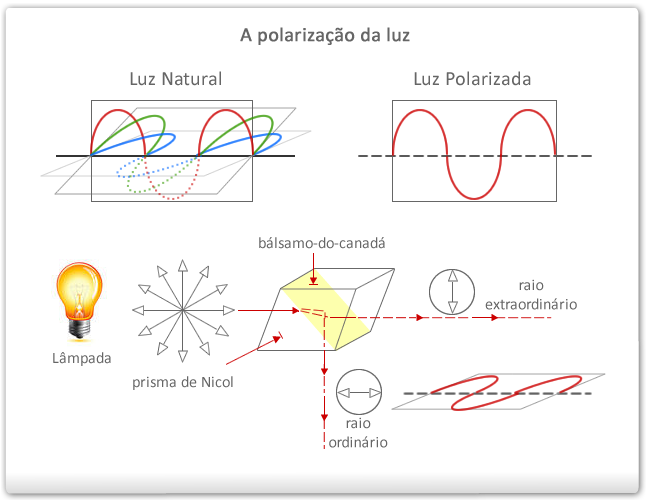
Luz natural é um conjunto de ondas eletromagnéticas que vibram em vários planos, perpendiculares à direção de propagação do feixe luminoso.
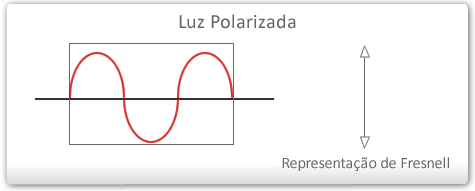
Luz polarizada – é um conjunto de ondas eletromagnéticas que vibram ao longo de um único plano.
É possível obter uma luz polarizada fazendo uma luz natural passar por uma substância natural polarizadora, como o prisma de Nicol, construído colocando-se dois cristais de calcita “com bálsamo-do-canadá, ou ainda uma lente polaroide.
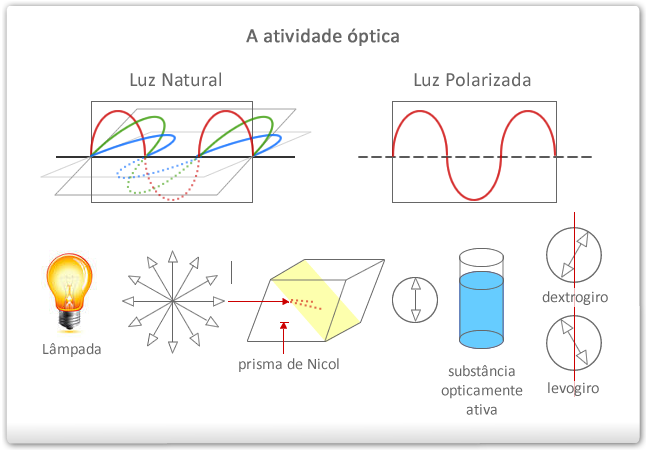
Algumas substâncias são capazes de provocar um desvio no plano da luz polarizada. Estas substâncias possuem atividade óptica (opticamente ativas) e pode ser medida através de um polarímetro.
Chamamos de dextrógira a substância que desvia o plano de vibração da luz polarizada para a direita e a representamos por “d” ou (+). Será levógira a substância que desvia o plano de vibração da luz polarizada para a esquerda e a representamos por “l” ou ( – ).
As formas dextrógira e levógira, que correspondem uma imagem da outra, foram chamadas antípodas ópticos ou enantiomorfos. A mistura em partes iguais dos antípodas ópticos fornece por compensação dos efeitos contrários um conjunto opticamente inativo, que foi chamado mistura racêmica.
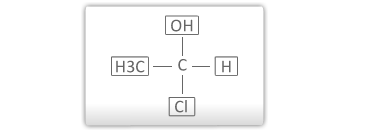
As substâncias assimétricas possuem atividade óptica. Se em uma estrutura orgânica aparece um carbono assimétrico (possui os quatroligantes diferentes) ela possuirá atividade óptica (opticamente ativa).
No composto abaixo, o carbono em destaque é ASSIMÉTRICO (termo antigo) ou QUIRAL.

Para uma substância orgânica, com carbono assimétrico, o número de isômeros ativos e inativos é dado pela expressão:
 |  | |
|
2n nº de isômeros ativos 2n-1 nº de isomêros inativos n é o nº de átomos de carbono assimétricos diferentes | ||
 |  |
Casos interessantes de Isomeria:
a) Isomeria Óptica com 1 Carbono Quiral
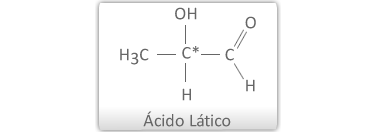
Podemos representar os isômeros opticamente ativos da seguinte maneira:
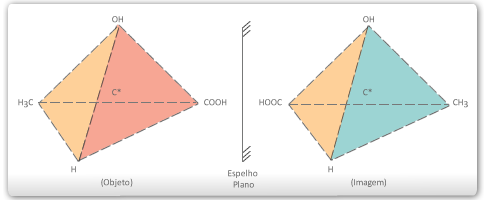
Todo composto que apresenta um carbono quiral na molécula será representado sempre por dois isômeros opticamente ativos: um dextrogiro e outro levogiro, cujas moléculas funcionam como objeto e imagem em relação a um espelho plano.
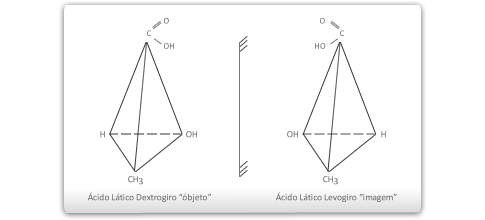
A todo isômero dextrogiro corresponde um levogiro, os dois desviam o plano de vibração da luz polarizada do mesmo ângulo para lados opostos. Assim, o primeiro desviará de +![]() e, o segundo, de –
e, o segundo, de –![]() . Os isômeros que são imagem um do outro num espelho plano denominam-se enantiômeros.
. Os isômeros que são imagem um do outro num espelho plano denominam-se enantiômeros.
![]() As moléculas que não se podem sobrepor às respectivas imagens num espelho plano são denominadas de quirais (antigamente denominadas de assimétricas). Portanto, num composto cujas moléculas são quirais, encontramos moléculas dextrogiras e levogiras (enantiômeros).
As moléculas que não se podem sobrepor às respectivas imagens num espelho plano são denominadas de quirais (antigamente denominadas de assimétricas). Portanto, num composto cujas moléculas são quirais, encontramos moléculas dextrogiras e levogiras (enantiômeros).
![]()
Se misturarmos quantidades iguais de enantiômeros, obteremos o racêmico, que é opticamente inativo (inativo por compensação externa).
 |  | |
|
Observação Uma substância opticamente inativa não desvia o plano de luz polarizada. | ||
 |  |
Outros exemplos de compostos que apresentam um carbono quiral na molécula e que, por isso, são representados por enantiômeros e por racêmico.
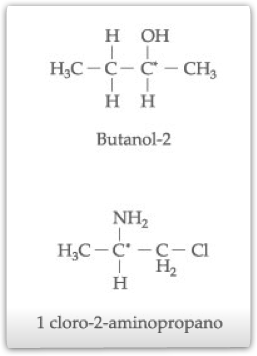
b) Isomeria Óptica Com 2 Carbonos Quirais Diferentes
Exemplo
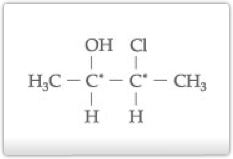
Os carbonos de números 2 e 3 são quirais e diferentes, pois um está ligado a – OH e, outro, ao Cl-.
Os ângulos de desvio produzidos por eles serão, portanto, diferentes.
Suponhamos que um seja responsável por um desvio ![]() e, outro, por
e, outro, por ![]() e convencionemos, por exemplo:
e convencionemos, por exemplo:
![]() >
> ![]()
Se representarmos por sinas + e – os desvios para a direita e para a esquerda, respectivamente, teremos os seguintes isômeros possíveis:
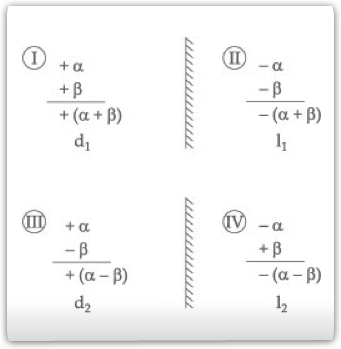
Se misturarmos quantidades iguais dos enantiômeros d1 e l1, teremos o racêmico r1.
![]()
Se fizermos o mesmo para os isômeros d2 e l2, teremos o racêmico r2.
![]()
Outros exemplos de compostos com dois carbonos quirais diferentes:
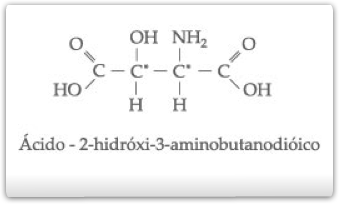
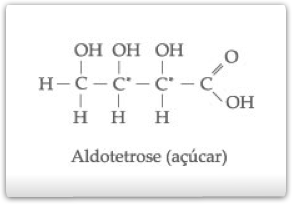
c) Isometria Óptica Com n Carbonos Quirais Diferentes

Fórmulas de Van’tHoff

d) Isometria Óptica, com dois Carbonos Quirais Iguais
Seja, por exemplo, o composto:
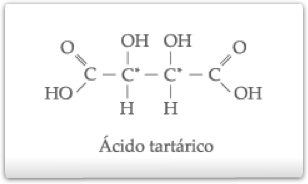
Os carbonos de números 2 e 3 são quirais, porém iguais. Se considerarmos, portanto, que um deles é responsável por um desvio a do plano de vibração da luz polarizada, o outro também o será.
![]()
O número de isômeros possíveis será o seguinte:
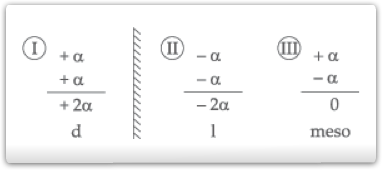
r = d + l (em quantidades iguais)
Conclusão
![]()
Toda fórmula que apresente dois carbonos quirais iguais será responsável por quatro possibilidades, sendo duas substâncias opticamente ativas, uma substância opticamente inativa e uma mistura racêmica.
Assim, para o ácido tartárico, as quatro possibilidades são as seguintes:
I)ácido tartárico dextrogiro.
II)ácido tartárico levogiro.
III)ácido mesotartárico ou ácido tartárico inativo por compensação interna.
IV) ácido tartárico racêmico ou ácido tartárico inativo por compensação externa.
Outros exemplos de compostos com dois carbonos quirais iguais:
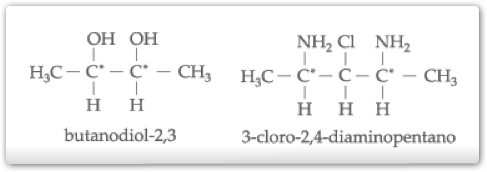
e) Isometria Óptica em dois compostos Cíclicos
Isomeria óptica também é observada em compostos cíclicos, embora estes não apresentem carbono quiral. Para que a quantidade de isômeros possa ser determinada, devemos considerar a existência do carbono quiral.
O composto cíclico que apresenta assimetria molecular deve possuir carbono com ligantes diferentes. Consideremos o composto 2-metil-1-cloro-ciclopropano.
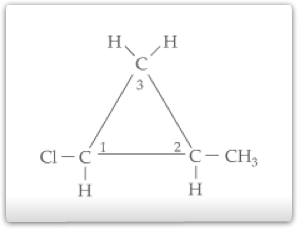
Observamos que existem dois carbonos no anel (1 e 2) que podem ser considerados como quirais. A quantidade de isômeros é calculada da seguinte maneira:
Isômeros opticamente ativos: 2n = 22 = 4
Isômeros opticamente inativos:
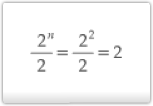
As fórmulas estruturais dos isômeros ficam:
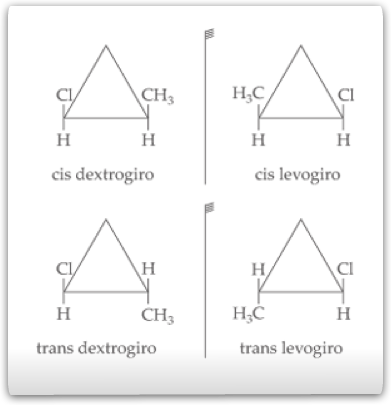
Quando dois carbonos do anel possuem os ligantes iguais entre si, possui assimetria molecular somente a forma trans. Consideremos a substância 1,2 dibromo-ciclopropano:
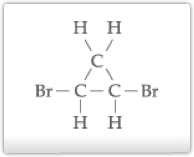
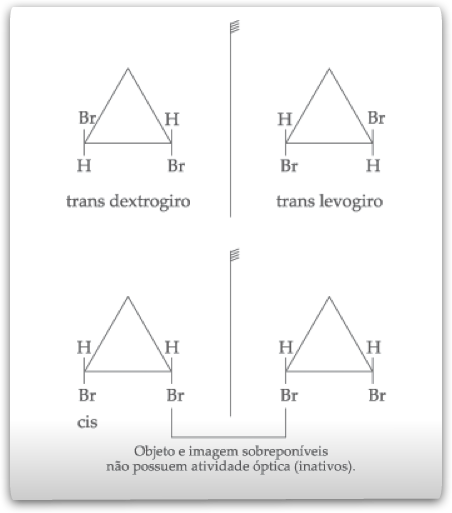
Isomeria Óptica:Estruturalmente,podemos representar os isõmeros ativos da seguinte forma:
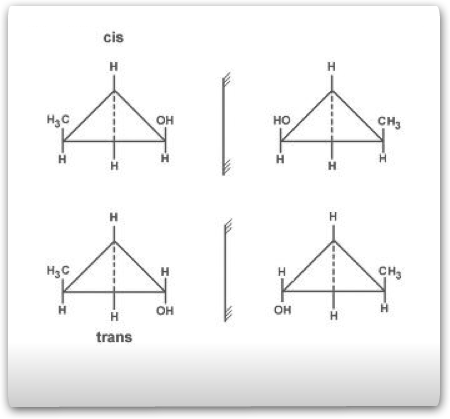
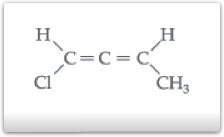
Compostos com duas duplas ligações
A isomeria ótica é observada nos compostos com duas duplas acumuladas, ou seja, no mesmo átomo de carbono. Tais compostos são denominados de alênicos.

Exemplo: