Reações de Oxirredução:
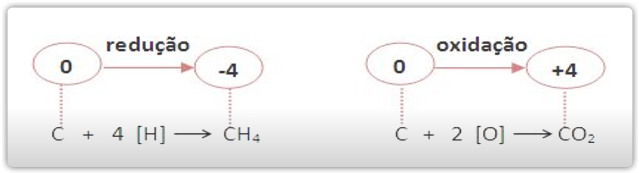
As reações de oxidorredução ocorrem com mudanças de número de oxidação. A oxidorredução é provocada pelas reações com oxigênio (oxidação) e com hidrogênio (redução).
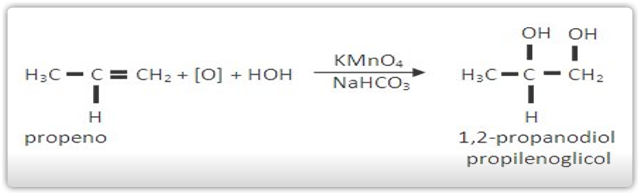
Oxidação branda de alcenos
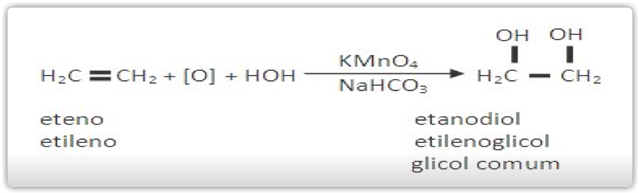
Os alcenos são todos oxidados pelo KMnO4 em meio básico (NaHCO3 ou Na2CO3) ou em meio neutro, formando diálcoois vicinais chamados glicóis.
O oxidante brando mais usado é o KMnO4/NaHCO3 , que é conhecido como Reativo de Baeyer.
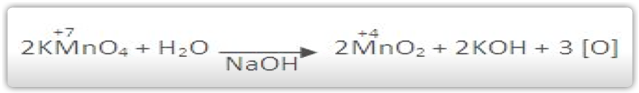
Em meio alcalino, o KMnO4 é um oxidante brando:
Exemplos de oxidação branda de alcenos:
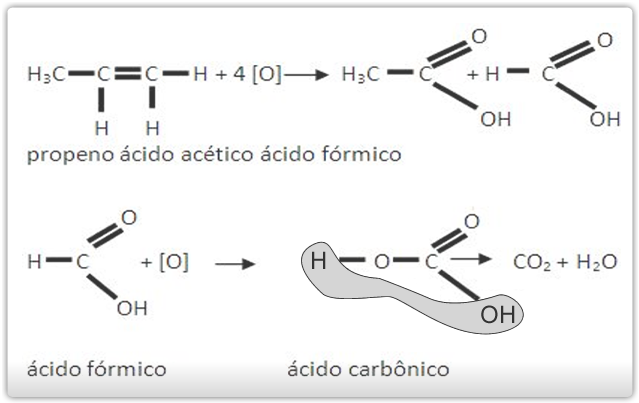
Oxidação enérgica são exemplos de oxidantes enérgicos, como a mistura sulfopermangânica (KMnO4/H2SO4) e mistura sulfocrômica (K2Cr2O7/H2SO4).
O KMnO4, em meio ácido sulfúrico, é considerado um oxidante enérgico:

Pode-se notar que a solução KMnO4 perde a cor, pois na reação a solução de cor violeta fica incolor.
Pode-se notar que com o K2Cr2O7 acontece reação parecida:
Vejamos:
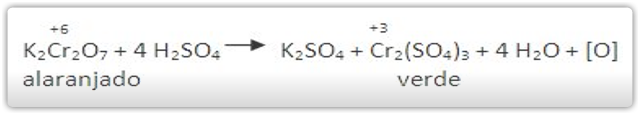
Oxidação enérgica de alcoóis
Um álcool primário quando está na presença do oxidante é oxidado a ácido carboxílico, já o álcool secundário, forma-se cetona, onde a oxidação da cetona só acontece nas condições energéticas e os terciários só irão se oxidar com oxidantes muito energéticos.
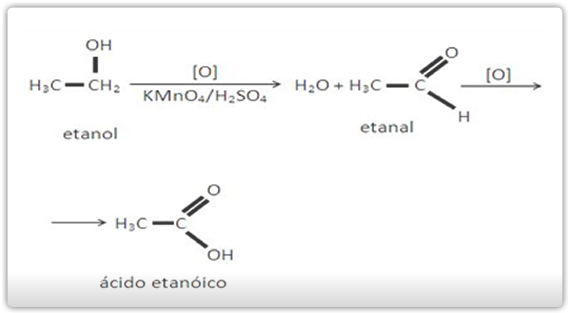
Oxidação de álcool secundário:

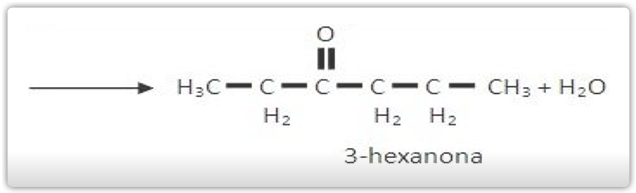
Oxidação enérgica de ciclanos
Na solução aquosa, os ciclanos resistem ao KMnO4, usado na diferenciação com alcenos.
Na presença de oxidante enérgico (HNO3 concentrado, KMnO4 em meio ácido), obtém-se a ruptura do ciclo, formando o ácido dicarboxílico.
Oxidação enérgica de hidrocarbonetos aromáticos
O ácido benzoico é formado a partir de hidrocarbonetos benzênicos junto com um grupo lateral. A ação dos oxidantes como mistura sulfocrômica e mistura sulfopermangânica, são suportadas pelo núcleo aromático.
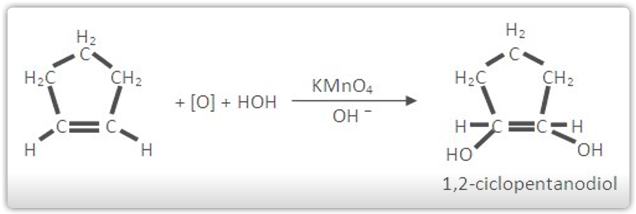
Os cicloalcenos apresentam reações de oxidação parecidas com as dos alcenos.
A) Ozonólise do ciclopenteno
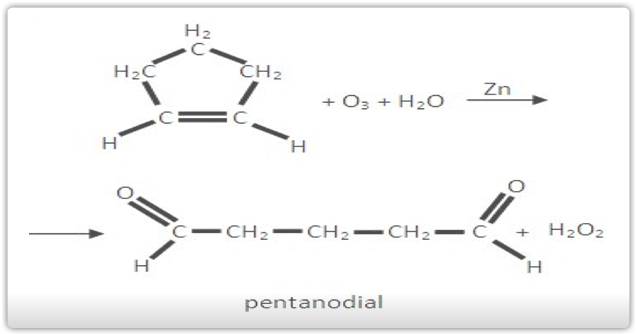
B) Oxidação enérgica
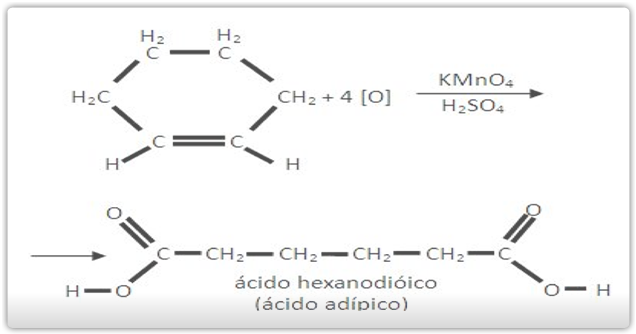
C) Oxidação branda do ciclopenteno (Baeyer)