Relação entre os efeitos eletrônicos, acidez e basicidade
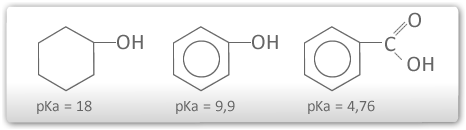
A acidez de compostos orgânicos como fenóis e ácidos carboxílicos e a baixa acidez de compostos como alcoóis pode ser explicada com base nos efeitos eletrônicos. Para apresentar uma acidez considerável ,o composto deve possuir algum fator que o ajude a deslocalizar a carga negativa do ânion(base conjugada)que é formado na ionização.A deslocalização ocorre por efeito ressonante.
Um fator que aumenta a força ácida de um composto é a deslocalização da carga negativa da base conjugada.
A acidez dos compostos pode ser avaliada pelo Ka. Quanto maior o Ka mais forte é o ácido e menor é o pKa.
| Ka | 10-18 | 10-16 | 10-10 | 10-5 |
| composto | álcool | água | fenol | Ácido carboxílico |
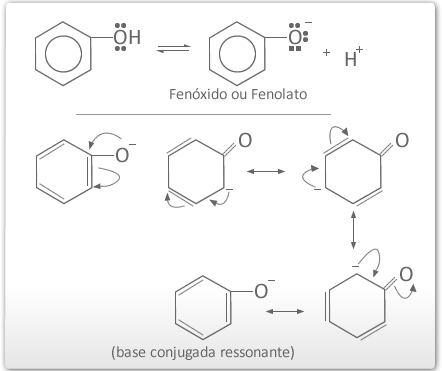
Deslocalização da carga negativa do ânion fenóxido
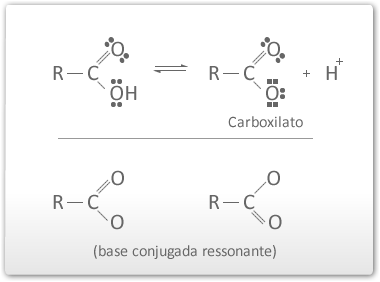
Deslocalização da carga negativa no ânion carboxilato
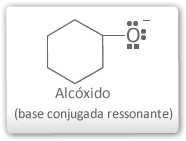
No ânion alcóxido de um álcool não existe deslocalização da carga negativa da base conjugada e o grupo alquil ligado ao oxigênio promove efeito indutivo positivo, aumentando a densidade eletrônica do oxigênio e diminuindo a estabilidade da base conjugada.
Por isso os álcoois possuem um caráter ácido menor que o da água.
 |  | |
|
Ácidos carboxílicos podem ser neutralizados por bases fortes,moderadas,fracas e sais de caráter básico como NaHCO3. Fenóis são neutralizados somente por bases fortes | ||
 |  |
Os efeitos eletrônicos podem também aumentar ou diminuir a acidez ou basicidade de um composto. Essa influência dos efeitos eletrônicos pode ser notada principalmente nos fenóis, ácidos carboxílicos e aminas.
a) Fenóis
A presença de grupos no anel aromático do fenol pode aumentar ou diminuir a acidez do fenol.
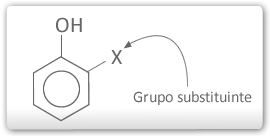
X⇒ Efeito eletrônico positivo ⇒diminui a acidez⇒ principalmente em orto e para.
X⇒ Efeito eletrônico negativo ⇒aumenta a acidez⇒ principalmente em orto e para.
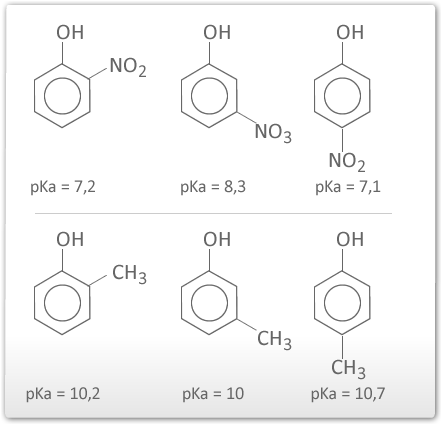
Lembre-se que quanto maior o Ka mais forte é o ácido e menor é o pKa
Os halogênios são exceções, pois podem fazer efeito indutivo negativo e mesômero positivo.
Os halogênios aumentam a acidez do fenol.
 |  | |
|
Os halogênios são exceções, pois podem fazer efeito indutivo negativo e mesômero positivo. Fenóis são neutralizados somente por bases fortes. Os halogênios aumentam a acidez do fenol. | ||
 |  |
b)Ácidos carboxílicos
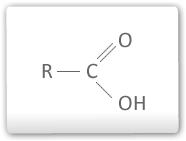
Quanto maior a cadeia de carbonos (R), menor é a acidez.
O grupo R promove efeito indutivo positivo diminuindo a estabilidade do ânion carboxilato.
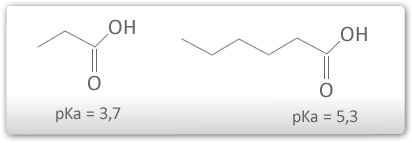
A presença de grupos que promovem efeito indutivo negativo no grupo R aumenta a acidez do ácido carboxílico. Quanto maior o número de grupos, e quanto menor a distância da carboxila, maior é a acidez.

O efeito indutivo negativo ajuda a deslocalizar a carga negativa do ânion carboxilato aumentando assim a sua estabilidade.
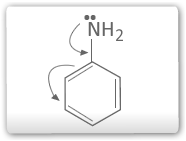
c) Aminas
Possuem a seguinte ordem decrescente de basicidade:
Quanto maior o Kb mais forte é abase e menor é o pKb.
 |  | |
|
Aminas secundárias > Aminas primárias > Aminas terciárias >NH3 > Aminas aromáticas | ||
 |  |
 |  | |
|
Dimetilamina Kb=5,2.10-4(secundária) Metilamina Kb=4,4.10-4(primária) trimetilamina Kb=0,62.10-4(terciária) Amõnia Kb=1,8.10-5 Fenilamina Kb=3,8.10-10(aromática)
| ||
 |  |
As aminas secundárias possuem dois grupos alquilas doadores de elétrons (efeito indutivo positivo), sendo, portanto, mais básica que as aminas primárias.Esse efeito aumenta a densidade eletrônica do nitrogênio facilitando a doação do seu par eletrônico. Considerando-se apenas o efeito indutivo dos grupos alquilas, era de se esperar que as aminas terciárias fossem mias básicas. Entretanto a presença de três grupos alquilas em torno do nitrogênio dificulta a aproximação do cátion H+(impedimento espacial ou estérico). Já as aminas aromáticas são menos básicas que a amônia por que o par de elétrons não ligante do nitrogênio pode deslocalizar-se sobre o anel aromático (efeito mesomérico poistivo), tornado-se dessa forma menos disponível para se ligar ao H+